Viết phương trình hóa học điều chế Al từ Al2O3 và tính khối lượng Al2O3 cần dùng để sản xuất 2,7 tấn với hiệu suất là 80%.
-Làm ơn giúp mình. Mình đang cần gấp. Mình cảm ơn-
Tính KL Al2O3 cần dùng để sản xuất 1000 tấn nhôm
biết: Al2O3→ Al+ O2
Giúp em nhanh với ạ, em cần gấp. Xin cảm ơn
PTHH: \(2Al_2O_3-^{đpnccriolit}\rightarrow4Al+3O_2\)
TPT: 204------------------------108----96 (tấn)
TĐB: ?<------------------------1000(tấn)
\(\Rightarrow m_{Al_2O_3}=\dfrac{1000.204}{108}=1888,89\left(tấn\right)\)
Nung KNO3 chất này phân huỷ thành KNO2 và O2
a) Viết PTPU
b) Tính khối lượng KNO3 cần dùng để điều chế 2,4g oxi biết hiệu xuất phản ứng đạt 85% theo lí thuyết
c) Tính khối lượng oxi điều chế từ 10,1g KNO3 biết hiệu xuất phản ứng đạt 85% theo lí thuyết
Làm giúp mình với nhé. Mình cảm ơn nhiều lắm
a.
KN03 --> KN02 + 1/2 02
b.
n 02 = 0,075 mol
mà H% đạt 85%
=> n 02 lí thuyết thu đc = 0,075*100/85 = 3/34 mol
KN03 --> KN02 + 1/2 02
3/17 mol <---- 3/34 mol
vậy n KN03 = 3/17 mol
c.
n KN03 = 0,1
KN03 ---> KN02 + 1/2 02
lí thuyết:..0,1 -----------------> 0,05
mà H% = 80%
=> n 02 thu được = 0,05*80/100 = 0,04 mol
=> V 02 thực tế thu dc = 0,896 lit
a. KN03 --> KN02 + 1/2 02 b. n 02 = 0,075 mol mà H% đạt 85% => n 02 lí thuyết thu đc = 0,075*100/85 = 3/34 mol KN03 --> KN02 + 1/2 02 3/17 mol <---- 3/34 mol vậy n KN03 = 3/17 mol c. n KN03 = 0,1 KN03 ---> KN02 + 1/2 02 lí thuyết:..0,1 -----------> 0,05 mà H% = 80% => n 02 thu được = 0,05*80/100 = 0,04 mol => V 02 thực tế thu dc = 0,896 lit
Thành phần của đất đèn chứa 80% canxicacbua. a) Tính khối lượng đất đèn cần thiết để điều chế được 6,72l khí axetilen. b) Nếu hiệu suất phản ứng là 80% thì lượng đất đèn cần sử dụng là bao nhiêu? Giúp mình với ạ, mình xin cảm ơn ạ
a) CaC2 (0,3 mol) + 2H2O \(\rightarrow\) Ca(OH)2 + C2H2 (0,3 mol).
Số mol khí axetilen là 6,72/22,4=0,3 (mol).
Khối lượng đất đèn cần dùng là 0,3.64.100:80=24 (g).
b) Nếu hiệu suất phản ứng là 80% thì lượng đất đèn cần sử dụng là 24.100:80=30 (g).
Người ta dùng quặng boxit để sản xuất Al. Hàm lượng Al 2 O 3 trong quặng là 40%. Để có được 4 tấn nhôm nguyên chất cần bao nhiêu tấn quặng ? Biết rằng hiệu suất của quá trình sản xuất là 90%.
Thực tế do một số nguyên nhân, chất tham gia phản ứng không tác dụng hết, nghĩa là hiệu suất dưới 100%. Người ta có thể tính hiệu suất phản ứng như sau :
1. Dựa vào một trong các chất tham gia phản ứng, công thức tính :

2.Dựa vào một trong các chất tạo thành, công thức tính :
2 Al 2 O 3 → 4Al + 3 O 2
Dựa vào phương trình ta có: Cứ 204g Al 2 O 3 thì tạo ra 108g Al
⇒ Để tạo ra 4 tấn Al thì khối lượng Al 2 O 3 cần = 4.204/108 = 7,55g
Hiệu suất phản ứng là 90%, có nghĩa là 7,55 tấn Al 2 O 3 chỉ chiếm 90% khối lượng phải dùng.
Khối lượng oxit phải dùng : 7,55x100/90 = 8,39 tấn
Khối lượng quặng boxit: 8,39x100/40 = 20,972 tấn
Viết phương trình hóa học của các phản ứng theo sơ đồ chuyển hóa sau:
O2 -> H2O -> O2 -> Al2O3
(giúp mk với ạ, mk đang cần gấp. Cảm ơn)
\(H_2+\dfrac{1}{2}O_{_{ }2}\underrightarrow{t^0}H_2O\)
\(H_2O\underrightarrow{đp}H_2+\dfrac{1}{2}O_2\)
\(4Al+3O_2\underrightarrow{t^0}2Al_2O_3\)
O2 + 2H2 --to--> 2H2O
2H2O ----điện-phân----> 2H2 + O2
3O2 + 4Al --to--> 2Al2O3.
Nhôm oxit có công thức hóa học Al2O3 :
- tính phần trăm khối lượng mỗi nguyên tố trong hợp chất Al2O3
( cho Al = 27 , O = 16)
mình đang cần gấp
Ta có: MAl2O3 = 27.2+16.3 = 102 g/mol
%Al = 27.210227.2102.100% = 52,94%
%O = 16.310216.3102.100% = 47,06%
Cho dãy chuyển hóa sau:
Xenlulozo → 1 A1 → 2 A2 → 3 A3 → 4 PE
a. Viết các phương trình hóa học, ghi rõ điều kiện thực hiện chuyển hóa trên.
b. Tính khối lượng gỗ có chứa 40% xenlulozo cần dùng để sản xuất 14 tấn nhựa PE, biết hiệu suất chung của cả quá trình là 60%.
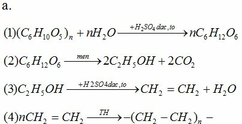
b.
Khối lượng gỗ cần dùng = (14 . 162) : (28 . 2 . 40% . 60%) = 168,75 tấn
Trong quặng Bô-xit trung bình có 50% Al2O3. Kim loại luyện được từ Oxit đó có chứa 1,5% tạp chất. Tính lượng Al nguyên chất được điều chế từ nửa tấn quặng Bô-xít. Cho biết rằng để luyện nhân nguyên chất dùng phương trình hóa học luyện Al:
Al2O3 = Al + O2
Nửa tấn=500000g
2Al2O3-->4Al+3O2
Khối lượng Al2O3 nguyên chất trong nửa tấn quặng bô-xít là
500000.50%=250000(g)
Số mol của Al2O3 là
n=m/M=250000/102
=125000/51(mol)
Số mol của Al là
nAl=2nAl2O3=2.125000/51
=250000/51(mol)
Khối lượng của Al là
m=n.M=250000/51.27
=2250000/17( g)
Khối lượng của Al nguyên chất là
2250000/17-
(2250000/17.1.5%)
=2216250/17(g)
Để điều chế được cao su buna từ mùn cưa, người ta thực hiện theo 4 quá trình chuyển hóa có hiệu suất tương ứng là 60%; 80%; 35%; 80%. Vậy khối lượng mùn cưa (có 60% xenlulozơ) cần để sản xuất 1 tấn cao su buna là
A. 22,321 tấn
B. 29,762 tấn
C. 34,800 tấn
D. 37,202 tấn